قبل أن نشرع في شرح هذه الظاهرة فلابد أن نشرح عدة مفاهيم و التي سوف تشكل القاعدة الأساسية لما سوف نقوم بشرحه بخصوص ظاهرة التبخر .

نأخذ على سبيل المثال الماء و الذي يتكون من جزيئات H2O وهي جزيئة تتكون من ذرة واحد من الأكسجين و ذرتين من الهدروجين و تتميز هذه الجزيئة بأنها قطبية أي أن الأكسجين بحكم أن له كهرسلبية كبيرة مقارنة مع الهيدروحين فإنه يجذب زوج الإلكترونات التي تشكل الرابطة التساهمية نحوه مما يجعل الأكسجين له شحنة سالبة زائدة في حين الهيدروجين له شحنة موجبة زائدة .
وهنا نقول أن الجزيئة قطبية أي لها قطب موجب الذي هو ذرتي الهيدروجين و قطب سالب الذي هو ذرة الأكسجين و نعرف فيزيائياً هذا الإستقطاب بالعزم القطبي الكهربائي ، يسمى هذا العزم القطبي الكهربائي الذي تشكله جزيئة الماء بالعزم القطبي الدائم لأنه على المستوى الميكروسكوبي يكون دائماً موجود لكن على المستوى الماكروسكوبي فالماء محايد كهربائياً ، لأن مجموع هذه العزوم القطبية الكهربائية الكلية التي تشكلها جزيئات الماء يكون منعدماً بفعل الإرتجاج الحراري ، فالحرارة تؤثر على هذه العزوم بحيث تأخذ إتجاهات عشوائية على المستوى الميكروسكوبي بطريقة تجعل المجموع الكلي لهم منعدم ، و هذا الإستقطاب الذي تمتلكه الجزيئات هو ما يجعل الماء يتماسك ببعضه البعض نتيجة للقوى الكهروسطاتيكية الناتجة عن هذه العزوم القطبية الكهربائية .
لكن هناك جزيئات غير قطبية لكن تتوفر على عزوم قطبية كهربائية لحظية والتي تظهر وتختفي لحظياً وهي ما تجعل المادة كذلك متماسكة بعضها ببعض ونفس الشيء ينطبق على الذرات .
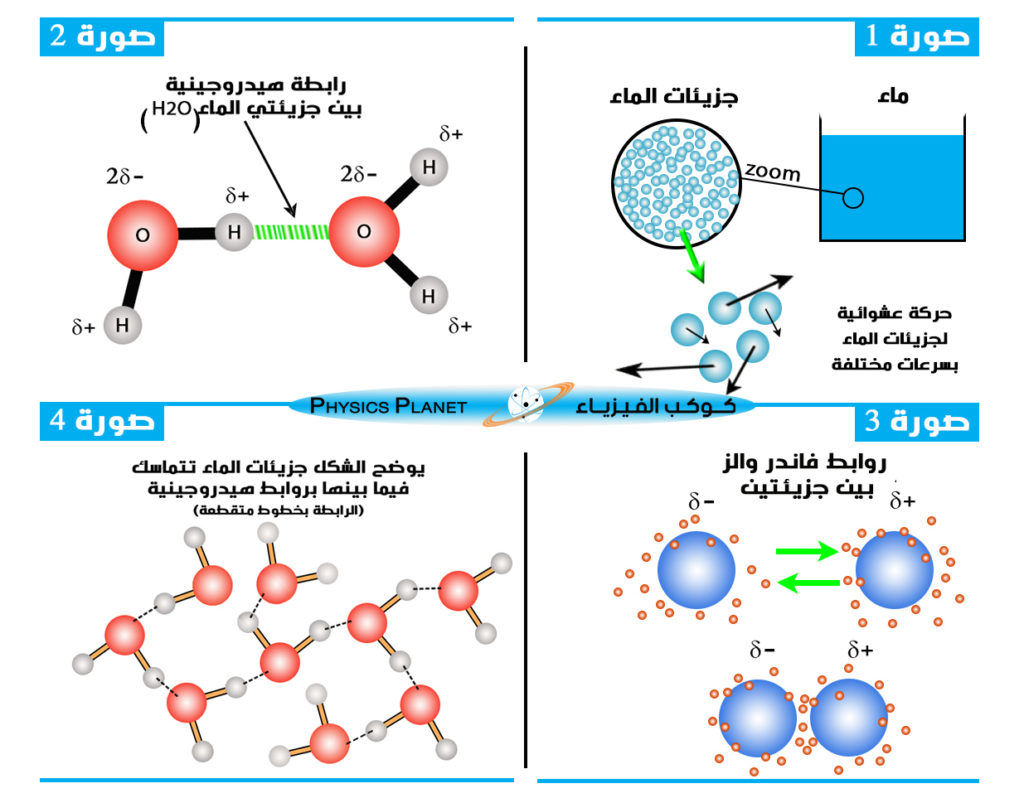
عندما نتكلم عن تماسك المادة على المستوى الذري او الجزيئي فإننا نتكلم عن قوى كهروسطاتيكية بين مكونات المادة التي تنشأ نتيجة لظهور العزوم القطبية الكهربائية ، و هذه القوى أنواع منها ما ينتج روابط هيدروجينية كما في حالة الماء ( الصورة 2) حيث تنشأ جزيئة الماء روابط هيدروجينية مع الجزيئات التي تحيط بها ، و تتم هذه الروابط في الماء عبر الشكل التالي ، تنجز ذرتي الهيدروجين في جزيئة الماء روابط ثانوية أخرى قصيرة المدى وبقوة ضعيفة قليلاً مقارنة مع الروابط التساهمية مع ذرات الأكسجين التي بجوارها و نفس الشيء يفعله الأكسيجين مع ذرات الهيدروجين بجواره ، الأمر الذي يجعل الجزيئات تتماسك ببعضها البعض لتشكل جزء واحد متكامل و هو ما نسميه بالمادة على المستوى الماكروسكوبي أي الماء في حالتنا ، كما أنه هناك روابط أخرى غير الروابط الهيدروجينية تسمى بروابط فاندر والز (الصورة 3) منها ما هو قصير المدى وما هو بعيد المدى ، فكل هذه الروابط التي تنشأ بين عناصر المادة سواء ذرات أو جزيئات منبعها كهربائي محض وهي ما تجعل المادة متماسكة على المستوى الذري و الجزيئي (الصورة 4) .

بصفة عامة على المستوى الميكروسكوبي فإن الجزيئات تمتلك طاقة كلية Et و التي هي مجموع طاقتها الحركية Ec و طاقة جهدها Ep ، الطاقة الحركية هي الطاقة التي تمتلكها الجزيئات نتيجة لحركتها و منبعها حراري أي كلما ارتفعت درجة حرارة الماء كلما كانت الطاقة الحركية للجزيئات أكبر ، أما طاقة الجهد فهي الطاقة التي تمتلكها الجزيئات نتيجة لتفاعلها مع الجزيئات المجاورة لها ، فهي ناتجة عن القوى الكهروسطاتيكية بين الجزيئات .
نأخذ على سبيل المثال الحالة التي تكون فيها درجة حرارة الماء منعدمة أي صفر كيلفن T=0K فإن الطاقة الحركية للجزيئات سوف تكون منعدمة ، لكن طاقة الجهد الناتجة عن القوى الكهروسطاتيكية فهي غير منعدمة و هي التي تبقي المادة متماسكة دائماً ، بل هي تزداد تماسكاً وترتيباً في غياب الحرارة فنسمي هذه الحالة بالكريسطال ، حيث تكون الطاقة الكلية Et لجزيئة الماء هي طاقة الجهد Ep فقط ، لكن في كوننا لم يسبق أن إستطاع أحد ما الوصول الى الصفر كيلفن .
في حالة بداية ارتفاع درجة الحرارة تدريجياً تبدأ الجزيئات باكتساب طاقة حركية مما يجعلها تبدأ بالحركة بسرعات مختلفة في كل الإتجاهات ، سرعات الجزيئات على المستوى الجزيئي ليست متساوية بالنسبة لكل الجزيئات بل هي مختلفة (الصورة 1) ، هناك جزيئات تمتلك سرعات عالية و هناك من تمتلك سرعات منخفضة و بما أن الطاقة الحركية مرتبطة بسرعة الجزيئات إذن فالجزيئات لا تمتلك بالضرورة نفس الطاقة الحركية بل هي تختلق من جزيئة الى اخرى .
ومنه نستنتج أن الطاقة الكلية Et للجزيئات التي تكون الماء ليست نفسها بالنسبة لكل الجزيئات بل تختلف من جزيئة الى اخرى ونتيجة للتصادمات بين الجزيئات فإن الجزيئات تتبادل الطاقة الحركية فيما بينها حسب مبدأ إنحفاظ كمية الحركة ، فمثلاً جزيئة لها سرعة كبيرة إذن طاقتها الحركية كبيرة فإذا صدمت بجزيئة أخرى لها سرعة ضعيفة فإنها سوف تعطيها جزء كبير من طاقتها الحركية مما سوف يجعل الطاقة الكلية للجزيئة الثانية أكبر من الأولى التي صدمتها وهكذا يستمر التبادل الطاقي بين الجزيئات نتيجة للإصطدامات المتبادلة .
وتجدر الإشارة هنا الى أنه كلما أصبحت الطاقة الحركية للجزيئات كبيرة كلما أصبحت أكثر حركية وهذا يعني أنه إذا أصبحت الطاقة الحركية أكبر بكثير من طاقة الجهد الناتجة عن القوى الكهروسطاتيكية تصبح وكأن جزيئات المادة أقل إرتباطاً فيما بينها ، يعني يمكن أن نقول أن تزويد المادة بالحرارة سوف يجعل الجزيئات أكثر حركية أي أن الحرارة تعمل على إضعاف القوى الكهروسطاتيكية مما يجعل المادة أقل تماسكاً .
التبخر هو صعود مستمر لجزيئات الماء الى الهواء مهما كانت درجة حرارة الجو …

التبخر يتطلب من جزيئة الماء H2O أن تمتلك طاقة حركية معينة ، وكما سبق وشرحنا فإنه عند درجة الحرارة الإعتيادية 25 درجة سيليسيوس مثلاً فإن الجزيئات تمتلك طاقة حركية داخل محلول الماء ، الجزيئات التي توجد داخل المحلول فهي ممسوكة نسبياً من جميع الجوانب بالجزيئات الأخرى المحيطة بها بفعل القوى الكهروسطاتيكية في حين أن الجزيئات التي توجد في سطح الماء و التي في تماس مع الهواء فهي مشدودة فقط من الأسفل بفعل القوى الكهروسطاتيكية لكنها أكثر تحرراً من الجهة الملامسة للهواء مما يجعلها أقل إرتباطاً مع الماء بالأسفل ، فبمجرد ما أن تصدمها جزيئة أخرى من الأسفل لها طاقة حركية كبيرة سوف تكسبها طاقة حركية كبيرة تحررها من الماء و تتطيار في الهواء ، الأمر كله متوقف على الطاقة الحركية للجزيئات .

أولاً : مساحة التماس مع الهواء أي سطح الماء الملامس للهواء ، فكلما كان سطح الماء الملامس للهواء كبير كلما كانت عدد الجزيئات التي تستطيع الإفلات من الماء نحو الهواء كبيرة .
ثانياً : سرعة الرياح فكلما كانت الرياح قوية كانت الجزيئات التي تكون الرياح تسير بسرعة كبيرة أي تمتلك طاقة حركية كبيرة و اصطدام جزيئات الهواء مع الجزيئات التي على سطح الماء سوف يكسبه جزيئات الماء في السطح طاقة حركية كبيرة مما سوف يزيد من عملية التبخر .
ثالثاً : وهذه هي الأكثر أهمية و هي رفع درجة حرارة الماء عبر تزويده بالطاقة الحرارية فكلما ارتفعت درجة حرارة الماء كلما أصبحت الطاقة الحركية لجزيئات الماء كبيرة كلما أصبح عدد الجزيئات المتبخرة كبيراً .
وهذا واضح جداً ففي حياتنا اليومية نعلم أن تعريض الملابس الى الشمس يسرع من تجفيفها لأن اشعة الشمس ترفع من درجة حرارة الملابس أي انها تزود الماء الذي يوجد في الملابس بالحرارة ، مما يكسب جزيئات الماء طاقة حركية كبيرة وهذا سوف يسرع من انفلاتها نحو الهوء .
وكذلك اذا كانت الرياح قوية فإن الملابس سوف تجف بسرعة كبيرة كما شرحنا سابقاً لأن الرياح تعمل على الزيادة من الطاقة الحركية للجزيئات .

نحن نعلم حالياً أن الحرارة تزيد من عملية التبخر و لهذا فإنه إذا وضعنا قِدر من الماء على النار فإننا بذلك سنزود الماء بالحرارة مما سيجعل الطاقة الحركية لجزيئات الماء تتزايد وهذا بطيعة الحال سيعمل على تسريع عملية التبخر .
إن العلاقة بين التبخر و ارتفاع درجة حرارة الماء هي علاقة طردية أي كلما ارتفعت درجة حرارة الماء كلما إزداد صبيب الجزيئات المتبخرة من الماء ، صبيب التبخر هو عدد الجزيئات المتبخرة في كل ثانية .
ونحن نعلم أنه عند الضغط الجوي (واحد بار) أقصى ما يمكن أن تصل له درجة حرارة الماء هي 100 درجة سيليسيوس و تسمى بدرجة غليان الماء عند الضغط الحوي أي اللحظة التي يصل فيها صبيب تبخر جزيئات الماء مداه القصوي ، ثم يتوقف إرتفاع درجة الحرارة الماء و يستمر فقط التبخر بصبيب قصوي ، يعني أنه عند 100 درجة يصبح عدد جزيئات الماء المتبخرة في كل ثانية قصوي وثابت لا يمكن الزيادة فيه بالحرارة ولكن يمكن الزيادة في صبيب التبخر عبر الزيادة في سطح التماس مع الهواء .
لكن ما يجب أن نعلمه أن الماء لا يغلي فقط عند 100 درجة سيليسيوس و إنما يمكنه أن يغلي عند رجة حرارة أقل كما يمكنه أن يغلي عند درجة حرارة أكبر ، فالأمر متوقف على الضغط الذي يتواجد فيه الماء ، كلما إنخفض الضغط تناقصت درجة غليان الماء و العكس صحيح اذا ارتفع الضغط تزايدت درجة غليان الماء ، فمثلاً إذا صعدنا إلى قمة جبل إفرست و الذي يتواجد على علو 8848m من سطح الأرض تصبح درجة غليان الماء هي 72 درجة سيلسيوس فقط و لا يمكنه أن يتجاوزها وعندها يكون صبيب التبخر قصوي . أما في حالة وضع الماء داخل طنجرة الضغط (كوكوت مينوت) فإن درجة غليان الماء سوف تصبح هي 120 درجة سيليسيوس .
نعود الى التبخر و علاقته بالحرارة ، عندما نوقف النار تبدأ درجة حرارة الماء بالانخفاض فيبدأ صبيب التبخر يتناقص تدريجياً حتى تصل درجة حرارة الماء الى درجة حرارة الغرفة فيصبح صبيب التبخر ضعيف نسبياً لكنه غير مهمل بل لا تتوقف الجزيئات عن التبخر أصلاً مهما كانت درجة الحرارة ، فما يتغير هو صبيب التبخر حيث يكون كبيراً في درجة الحرارة الكبيرة ويكون صغيراً عندما تكون درجة الحرارة ضعيفة .
تبخر الماء عند درجة الحرارة الإعتيادية هو ما يجعل البحار و البرك المائية … تتبخر و هذا الماء الذي يتبخر هو ما يجعل الشتاء و الثلج يسقط و دورة تبخر المياه التي بسببها تسقط الشتاء معروفة والكل قد درسها بالإعدادي على ما أظن ، فلو لا ان الماء يتبخر عند اي درجة حرارة ما كانت لتكون هناك شتاء .

الماء الذي يصعد الى الجو يستمر في الصعود حتى يتكاثف في الطبقات العلوية وهو الذي يشكل السحب و الثلوج … ولكن تكاثف الماء في الطبقات العلوية يجعل الضغط الجوي يتناقص بسبب تناقص غاز الماء الموجود في الغلاف الجوي ولهذا فالماء المتبخر يصعد الى الهواء لكي يعيد توازن الضغط الجوي .

L’évaporisation : التبخر
L’ébullition : الغليان
Le moment dipôlaire électrique : العزم القطبي الكهربائي
Liaisons de Van der waals : روابط فاندر ولز
Laisons hydrogènes : روابط هيدروجينية
Débit d’évaporisation = صبيب التبخر
Force électrostatique : قوة كهروسطاتيكية
Molécule dipôlaire : جزيئة قطبية
Électronégativité :كهروسلبية
Moment dipôlaire permanent : عزم قطبي دائم
Moment dipôlaire instantannée : عزم قطبي لحظي
1bar : واحد بار
Montagne d’Everset : جبل إفرسيت
Marmite à pression : طنجرة الضغط
تحرير :شعيب المستعين El Moustaine Choaib

المسبح والهواء يوجدان في نفس درجة الحرارة، لكن عندما نقفز في المسبح نشعر بأنه أبرد من الهواء ! ما السبب في ذلك؟

لماذا تتعرق قنينة الماء عندما نخرجها من المُبرِد ؟
إقرأ أيضا
لماذا عندما نضع ورق على كأس به ماء و نقلب الكأس لا يسقط الماء بفعل الجاذبية ؟
- 2021-02-13
لماذا أرسلت الإمارات مسباراً إلى المريخ ؟
- 2021-02-08
هل تشعر الحيوانات بالحب ؟
- 2021-02-04
ما هو الانتخاب الطبيعي وكيف يحدث ؟
- 2021-01-30
لماذا السماء زرقاء ولماذا تبدو حمراء عند الشروق والغروب؟
- 2021-01-29
ماذا يحدث في أدمغتنا عندما نقع في الحب ؟
- 2021-01-26
قابلية رجوع الظواهر الطبيعية عكس الزمن
- 2021-01-24
ما هو المبدأ في الفيزياء وعلى أي أساس يتم بناؤه ؟
- 2021-01-23






2 Comments
مقالك اكثر من رائع تسلم استفدت منة كثير
مقال ممتاز